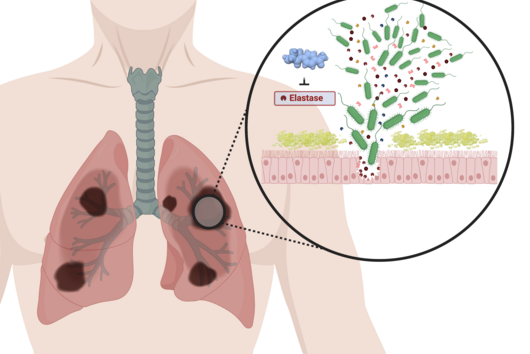
Saarbrücken, 8. Dezember 2021 - Ein Wirkstoff kann nur dann seine gewünschte Wirkung entfalten, wenn er seinen Zielort erreicht. Diese Aussage scheint einfach zu sein, doch die Wissenschaft, die dahinter steckt, kann eine Herausforderung sein. Zu verstehen, wie Wirkstoffe die bakterielle Zellhülle durchdringen, und Werkzeuge zu haben, um diesen Prozess richtig zu bewerten, ist von entscheidender Bedeutung - insbesondere bei der Entwicklung neuer Antibiotika. Wissenschaftler aus der Abteilung Wirkstofftransport über Biologische Barrieren und der Abteilung Mikrobielle Naturstoffe am HIPS haben nun einen Outer Membrane Vesicles (OMVs, dt. äußere Membranvesikel) Permeation Assay entwickelt, der als Hochdurchsatz-In-vitro-Screening-Tool zur Bewertung von substanz- und bakterienspezifischen passiven Aufnahmewegen dienen könnte. Sie berichten über diesen Assay in der Zeitschrift Advanced Healthcare Materials.
In Ihrem Forschungsartikel geht es um einen Assay zur Bewertung der bakteriellen Bioverfügbarkeit. Warum ist es so wichtig, ein Instrument zur Bestimmung der Permeabilität eines Antibiotikums zu haben, und was macht Ihren Assay im Vergleich zu früheren Ansätzen besonders?
Die Aufnahme von Antibiotika-Kandidaten zu prognostizieren ist oft entscheidend für ihre weitere Entwicklung, da eine ausreichende Verfügbarkeit am Zielort - man könnte von einer "bakteriellen Bioverfügbarkeit" sprechen - ihre Aktivität bestimmt. Insbesondere Bakterien mit einer doppelten Zellmembran (so genannte "Gram-negative") können die Antibiotikakonzentration innerhalb der Zelle wirksam kontrollieren, um ein schädliches Niveau zu vermeiden. Zu diesem Zweck nutzen sie beispielsweise membranassoziierte Porinproteine, Lipopolysaccharide und Effluxpumpen. Assays auf der Basis ganzer Zellen sind sehr bakterienspezifisch, erfordern sehr leistungsstarke Analysegeräte und bergen in der Regel ein Infektionsrisiko. Außerdem ist es schwierig, bestimmte akkumulationsbestimmende Faktoren auszuschließen. Daher sind diese Assays sehr komplex und nicht als Hochdurchsatz-Screening-Methode geeignet. Andere zellfreie Assays sind in ihrer Zusammensetzung stark vereinfacht, fragil und ebenfalls nicht für einen hohen Durchsatz geeignet. Unser OMV-basiertes Modell bietet die Möglichkeit, die Permeabilität von Antibiotika durch die äußere Membran abzuschätzen, die ein sehr wichtiger Faktor für die bakterielle Bioverfügbarkeit ist. Dies führt potenziell zu authentischen Permeationsdaten mit einem minimalen Bedarf an Arbeitskräften und analytischer Ausrüstung. Dies macht es in vielen verschiedenen Laboren anwendbar.
Können Sie uns ein wenig mehr über extrazelluläre Vesikel erzählen und was sie für Ihre Forschung interessant macht?
Extrazelluläre Vesikel sind wie winzige flüssigkeitsgefüllte Bläschen. Sie sind von einer Biomembran umgeben und werden von praktisch allen Arten von Zellen an ihre Umgebung abgegeben. Sie erfüllen verschiedene Aufgaben, zum Beispiel horizontalen Gentransfer, Kommunikation von Zelle zu Zelle, Verteidigung gegen räuberische Mikroorganismen oder Immunmodulation. OMVs sind eine Art von extrazellulären Vesikeln. Sie entstammen der äußeren Membran gramnegativer Bakterien und weisen typische Membranbestandteile wie Phospholipide, Lipopolysaccharide, Porine sowie Fragmente aktiver Aufnahme- oder Ausscheidungstransporter auf. Das macht sie als Material für ein in vitro-Membranpermeationsmodell attraktiv.
Wie haben Sie diese OMVs und den In-vitro-Test charakterisiert?
Aufgrund der Komplexität der OMVs benötigten wir verschiedene Charakterisierungsmethoden. Der Arbeitsablauf begann mit dynamischer Lichtstreuung, gefolgt von Laser-Doppler-Anemometrie und Nanopartikel-Tracking-Analyse, um ihre Größe, Oberflächenladung und Konzentration zu charakterisieren. Anschließend setzten wir mikroskopische Methoden wie konfokale Laser-Scanning-Mikroskopie, Rasterelektronenmikroskopie und Kryo-Transmissionselektronenmikroskopie ein, um die Form und das Verschmelzungsverhalten zu charakterisieren. Darüber hinaus wurden Proteinanalysen wie SDS-PAGE, Western Blot und MALDI-TOF-Massenspektrometrie eingesetzt, um zu bestätigen, dass das Material, mit dem wir es zu tun hatten, tatsächlich aus äußeren Membranvesikeln bestand.
Die Erstellung eines Membranmodells auf OMV-Basis scheint ein recht intensiver Prozess zu sein; können Sie uns den Arbeitsablauf erläutern?
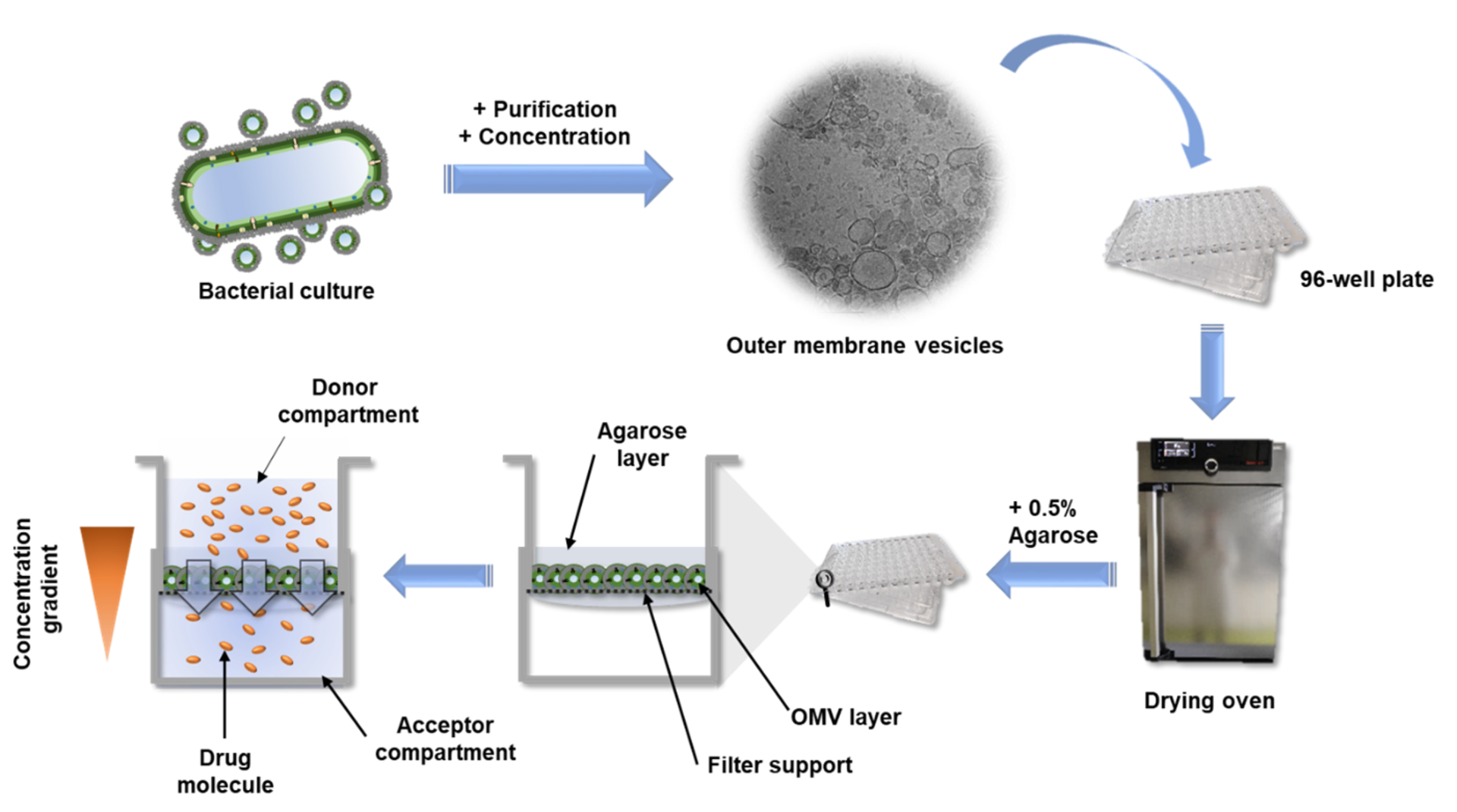
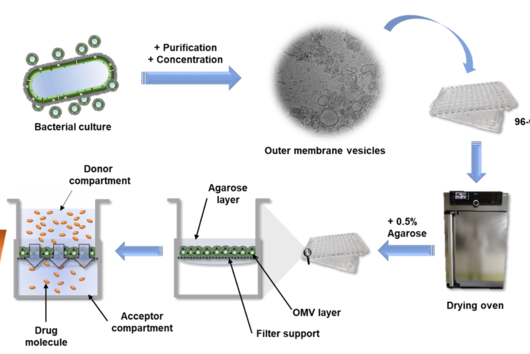
Im Vergleich zu den aufwändigen Charakterisierungen dieses Materials ist die Herstellung des OMV-basierten Modells recht einfach: Ein Bakterium von Interesse wird über einen bestimmten Zeitraum in Flüssigkultur gehalten. Anschließend wird das OMV-haltige Medium durch Zentrifugation und sterile Filtration von den Bakterien getrennt. Um die OMVs vom Medium zu trennen, haben wir uns entschieden, die OMVs mit einer konzentrierten PEG-Lösung (Polyethylenglykol) auszufällen. PEG bricht die Wasserstoffbrücken zwischen OMV und Wasser, so dass ein normaler Zentrifugationsschritt ausreicht, um das OMV-Pellet von der Flüssigkeit zu isolieren. Nach der Rekonstitution der Vesikel in Puffer, werden sie mehrfach auf Filterträgern verteilt und unter Luftstrom getrocknet. Um die Stabilität des Modells zu erhöhen, wird ein niedrig konzentriertes Agarosegel darüber gegeben, et voilà: das OMV-basierte Membranmodell ist fertig.
In Ihrem Artikel erwähnen Sie, dass dieser Test als Hochdurchsatz-Screening-Tool dienen könnte. Können Sie erklären, wie dies funktionieren würde und wie andere Wissenschaftler von Ihrem Test profitieren könnten?
Der hohe Durchsatz dieses Assays wird durch die Option ermöglicht, die Absorption oder Fluoreszenz eines Stoffes direkt von der 96-Well-Empfängerplatte abzulesen, auf der sich die Filterträger befinden. Alternativ können die Empfängerplatten in Spenderplatten umgewandelt werden, und die Probenahme kann in situ von der Oberseite der beschichteten Filterträger mit Hilfe von Liquid-Handling-Systemen erfolgen. Diese Proben können dann entweder durch UV-Vis-Spektrometrie, Fluorimetrie oder chromatographische Methoden quantifiziert werden. Da für diesen Test nur einfache Materialien erforderlich sind, kann er in verschiedenen Laboren eingesetzt werden, und die Anwendung ist leicht zu erlernen. Daher können andere Wissenschaftler ihre neuen Wirkstoffkandidaten leicht an ihrem selbst hergestellten OMV-basierten Modell testen und es vielleicht sogar weiter optimieren und charakterisieren. Das 'Linux' unter den in vitro Assays könnte man sagen.
Das Interview führten Dr. Alwin Hartman und Dr. Yannic Nonnenmacher.
ORIGINALPUBLIKATION
Richter, R., Kamal, M.A.M., Koch, M. et al. An Outer Membrane Vesicle-Based Permeation Assay (OMPA) for Assessing Bacterial Bioavailability. Advanced Healthcare Materials (2021). DOI: 10.1002/adhm.202101180











![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/c/9/csm_HZI_wiss_hemmhof_mik_001_611abc3df4.jpg)


![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/1/b/csm_Andreas_Keller_2023_org_4a279f0c07.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/b/3/csm_AufDiePlaetze_WID-8615_4ee837e55b.jpg)
![[Translate to German:] Künstliche Intelligenz unterstützt die Entdeckung von Arzneimitteln aus Naturstoffen](/fileadmin/HIPS/__processed__/3/e/csm_AI_in_NP_Drug_Discovery_AdobeStock_cb35048970.jpg)














![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/f/b/csm_Hegemann_Julian_a8a2ed3682.jpg)


![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/2/b/csm_HZI_wiss_pseudomonas_cpi_hzi_001_62730ae12d.jpg)