Saarbrücken, 18. Mai 2022 - Im hohen Alter lässt die Gedächtnisleistung bei den meisten Menschen nach, oft so stark, dass dies ihren Alltag massiv beeinflusst. Bioinformatiker:innen der Universität des Saarlandes (UdS) und des Helmholtz-Instituts für Pharmazeutische Forschung Saarland (HIPS) haben nun in einer gemeinsamen Studie mit der Stanford University ein Protein mit verjüngender Wirkung identifiziert, das den Prozess der abnehmenden Hirnleistung im Alter beeinflusst. Das HIPS ist eine gemeinsame Einrichtung des Helmholtz-Zentrums für Infektionsforschung (HZI) und der UdS. Ihre Forschungsergebnisse wurden online in der Fachpublikation Nature veröffentlicht.
Es gibt vielfältige Ursachen für altersbedingte Krankheiten – und oft führen diese zu erheblichen Einschränkungen im Alltag Betroffener. Eine der meistverbreiteten Symptome ist eine schleichend abnehmende kognitive Kapazität, die später oft gepaart mit Altersdemenz auftritt. Forscher der Universität des Saarlandes (UdS) interessieren sich daher für die Frage, welche neuen Stoffe uns neben einer gesunden Lebensweise dabei helfen können, so lange wie möglich fit im Gehirn zu bleiben. Sie suchen zudem nach Wirkstoffen, die Beschwerden bei bereits betroffenen Patienten wieder heilen können.
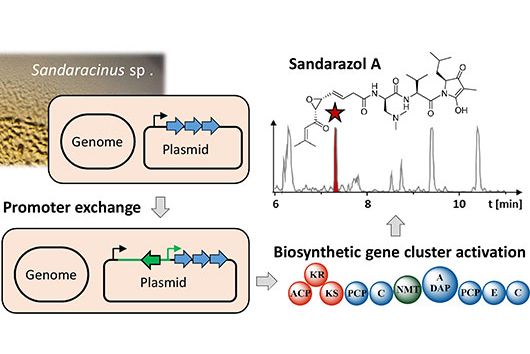
In einer Studie zusammen mit Forscher:innen der Gruppe von Prof. Tony Wyss-Coray aus dem Bereich Neurologie der Stanford University in den USA, die nun im renommierten Fachmagazin Nature publiziert wurde, beschreiben die Bioinformatiker Andreas Keller und Fabian Kern die Entdeckung eines solchen physiologisch wirksamen Stoffes. Andreas Keller ist Professor für Klinische Bioinformatik der Universität des Saarlandes. Sein wissenschaftlicher Mitarbeiter Fabian Kern forscht seit kurzem eigenständig am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS), wo er Infektionsprozesse auf Einzelzellebene räumlich und zeitlich aufgelöst untersuchen wird, um so die Erforschung neuer Wirkstoffe voranzutreiben. Zusammen haben sie wesentlich dazu beigetragen, den eigentlichen Mechanismus hinter der Wirkweise des sogenannten Signalproteins Fgf17 zu entschlüsseln. Dieses entstammt einer Familie von zellulären Wachstums- und Entwicklungsfaktoren. Das in der Gehirnflüssigkeit (auch bekannt als Cerebrospinalflüssigkeit - CSF) lösliche Protein dockt spezifisch an entsprechende Rezeptoren der Gehirnzellen, insbesondere den sogenannten Oligodendrozyten aus der Familie der Gliazellen, an. Diese sind für die elektrische Signalleitung unserer Neuronen unentbehrlich, können jedoch mit zunehmendem Alter an Anzahl und Funktion verlieren. Eine der bekanntesten Autoimmunkrankheiten, die unmittelbar auf einen Verlust der Oligodendrozytenfunktion zurückzuführen ist, ist die Multiple Sklerose. CSF enthält ein komplexes Gemisch an Nährstoffen, welches die Zellen im zentralen Nervensystem versorgt, sowie diverse Proteine mit nach wie vor unbekannter Funktionsweise.
Das in der Studie beschriebene, natürlich vorkommende Protein führt zu einer teilweisen Umkehrung der beobachteten Alterungsprozesse durch eine Reaktivierung von Oligodendrozyten und darüber hinaus zu einer signifikanten Verbesserung der kognitiven Schwächen. Dies konnte nachgewiesen werden, indem Rückenmarksflüssigkeit von jungen Labormäusen an ihre älteren Artgenossen per Transfusion übertragen wurde. Die Saarbrücker Bioinformatiker haben die an diesem konkreten molekularen Prozess beteiligten Transkriptionsfaktoren und Gene genauer beschrieben. Bis zu einer möglichen Therapie im Menschen sind jedoch noch viele weitere Fragen zu klären. Zum Einstieg ging es erst einmal darum, geeignete Wirkstoffkandidaten zu identifizieren, was sich in der Regel als überaus schwierig und aufwändig erweist. Die Bioinformatiker konnten in diesem Fall eine solche Entdeckung mit ihrem methodischen Wissen, wie unter Anderem in der Hochdurchsatzsequenzierung, erst möglich machen. „Fachübergreifende Forschung dieser Art mit ausgesuchter Nähe und Potential zur klinischen Nutzung gehören zu den Zielen der Universität im Bereich NanoBioMed. Damit werden richtungweisende Innovationen vom Campus in die ganze Welt getragen“, sagt Professor Andreas Keller mit Blick auf die nun im Nature-Magazin veröffentlichte Studie. Die Printausgabe des Artikels erscheint schließlich in der Ausgabe vom 19. Mai.
Originalpublikation
Iram, T., Kern, F., Kaur, A. et al. Young CSF restores oligodendrogenesis and memory in aged mice via Fgf17. Nature (2022). DOI: 10.1038/s41586-022-04722-0












![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/c/9/csm_HZI_wiss_hemmhof_mik_001_611abc3df4.jpg)


![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/1/b/csm_Andreas_Keller_2023_org_4a279f0c07.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/b/3/csm_AufDiePlaetze_WID-8615_4ee837e55b.jpg)
![[Translate to German:] Künstliche Intelligenz unterstützt die Entdeckung von Arzneimitteln aus Naturstoffen](/fileadmin/HIPS/__processed__/3/e/csm_AI_in_NP_Drug_Discovery_AdobeStock_cb35048970.jpg)












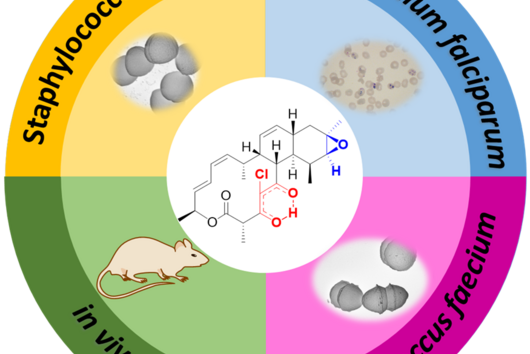
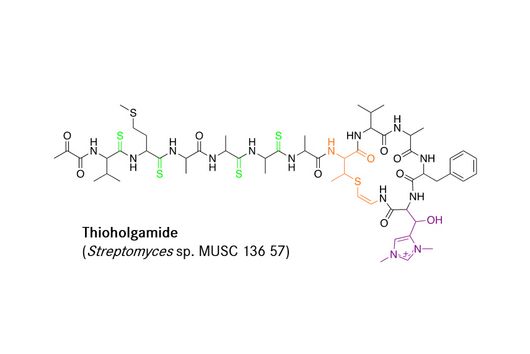

![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/f/b/csm_Hegemann_Julian_a8a2ed3682.jpg)
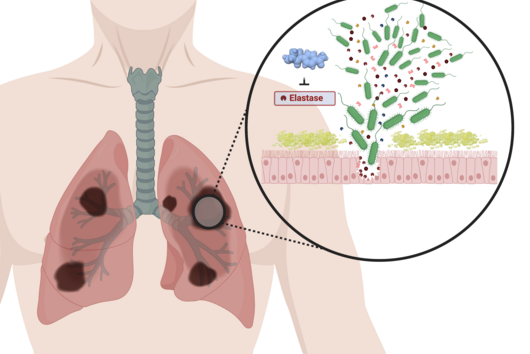
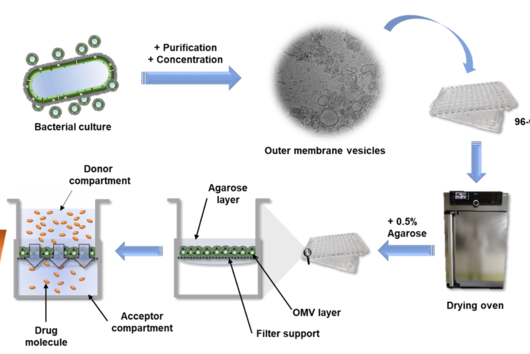


![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/2/b/csm_HZI_wiss_pseudomonas_cpi_hzi_001_62730ae12d.jpg)