Saarbrücken, 10. März 2021 - Cystobactamide sind eine Klasse an Naturstoffen mit vielversprechender Aktivität gegen multiresistente Bakterien. Forscher am HIPS versuchen deshalb diese Moleküle so zu optimieren, dass sie sich für eine Anwendung am Menschen eignen. Dr. Sebastian Groß hat zusammen mit Kollegen aus der Abteilung von Prof. Rolf Müller die einzelnen Schritte der Cystobactamid-Biosynthese in Myxobakterien aufgedeckt und damit den Weg für die weitere Optimierung der Substanzklasse geebnet. Ihre Ergebnisse konnten die Forscher in der Fachzeitschrift Nature Communications publizieren.
Sebastian, dein Paper befasst sich mit der myxobakteriellen Naturstoffklasse der Cystobactamide. Was macht diese Naturstoffklasse überhaupt interessant?
Aus pharmazeutischer Sicht sind Cystobactamide interessant, weil sie hochwirksam gegen Gram-negative Bakterien sind. Gram-negative Bakterien besitzen im Gegensatz zu Gram-positiven Bakterien eine doppelte Zellmembran, welche eine schwer überwindbare Barriere für viele Substanzen darstellt. Da viele multiresistente und schwer zu behandelnde Krankenhauskeime Gram-negativ sind, ist die Entdeckung und Weiterentwicklung neuartiger Antibiotika zur Bekämpfung dieser Erreger wichtig um auch zukünftig weiterhin wirksame Behandlungsoptionen zu haben.
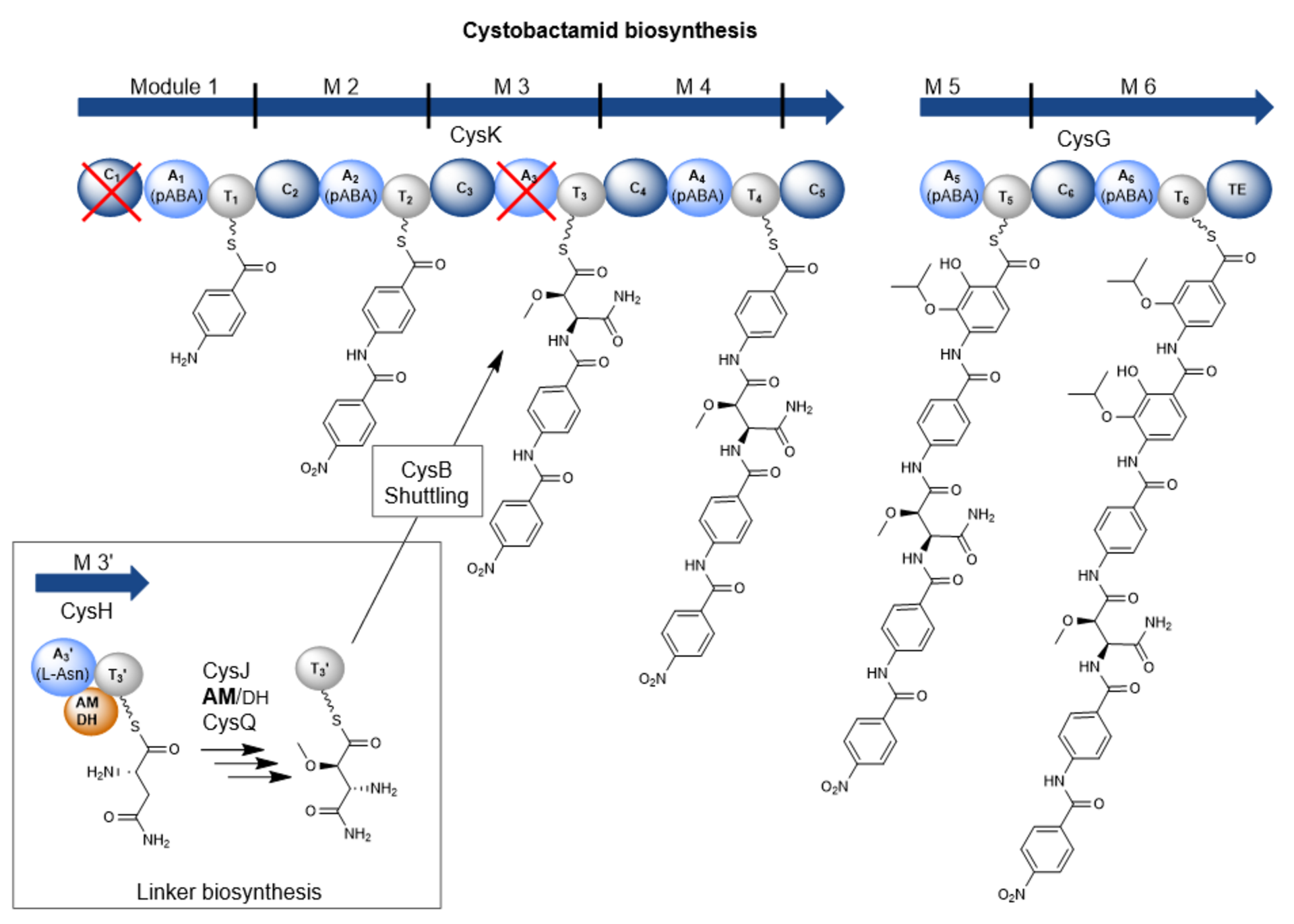
Cystobactamide sind aber auch aus struktureller und biosynthetischer Sicht interessante Moleküle. Sie bestehen hauptsächlich aus zum Teil modifizierten para-Aminobenzoesäure (pABA)-Bausteinen, welche in Naturstoffen nur sehr selten zu finden sind. Diese pABA-Bausteine sind über einen sogenannten Linker verbunden. In den bisher bekannten natürlichen Cystobactamid-Derivaten wurden unterschiedliche Linkerstrukturen identifiziert, wie zum Beispiel die α-methoxy-l-Isoasparagin-Einheit, die unter allen bisher bekannten Naturstoffen einzigartig ist.
Biosynthetisch werden Cystobactamide von einer Nichtribosomalen Peptidsynthetase (NRPS) produziert. Allerdings wurde in früheren Publikationen bereits vermutet, dass die Biosynthese der Cystobactamide einige Unterschiede im Vergleich zu Biosyntheseprozessen aus bereits bekannten NRPS-Systemen birgt.
Deshalb waren wir daran interessiert diese Biosyntheseschritte aufzuklären, insbesondere die des einzigartigen α-methoxy-L-Isoasparagin-Linkers.
Wie seid ihr bei der Aufklärung der einzelnen Schritte vorgegangen?
Wir haben dazu einerseits die Enzyme, die an der Biosynthese der Cystobactamide beteiligt sind, individuell in Escherichia coli produziert, aufgereinigt und im Anschluss deren Aktivität im Reagenzglas (in vitro) untersucht. Abhängig von hinzugegebenen Substraten, Cofaktoren und anderen Reaktionsbedingungen konnten wir auf diese Weise einige biosynthetische Reaktionen künstlich nachstellen.
Andererseits haben wir bestimmte Gene oder Teile von Genen, die an der Biosynthese beteiligte Enzyme kodieren, aus dem biosynthetischen Gencluster (BGC) entfernt. Daraus resultierten Veränderungen im Cystobactamid-Produktionsprofil des Bakteriums, welche uns Rückschlüsse auf die fehlenden oder veränderten biochemischen Reaktionsschritte ziehen ließen.
Im Paper verwendet ihr zur Produktion von Cystobactamiden und für die Aufklärung der Biosynthese Bakterien der Art Myxococcus xanthus. Hierbei handelt es sich allerdings nicht um einen natürlichen Produzenten von Cystobactamid. Wie funktioniert das und wieso habt Ihr diese Vorgehensweise gewählt?
Das ist richtig. Es gibt verschiedene Myxobakterienstämme, die in der Lage sind Cystobactamide zu produzieren. Dazu gehören beispielsweise Stämme der Gattungen Cystobacter, Myxococcus und Corallococcus. Alle diese Stämme haben jedoch gemein, dass sie unter Laborbedingungen nur zu relativ niedrigen Cystobactamid-Produktionsraten fähig sind. Deshalb sind wir für unsere Experimente auf den sehr gut charakterisierten myxobakteriellen Modellstamm Myxococcus xanthus DK1622 ausgewichen. Dieser Stamm produziert natürlicherweise keine Cystobactamide und deshalb mussten wir das gesamte biosynthetische Gencluster (BGC), in welchem alle Gene lokalisiert sind, die zur Produktion von Cystobactamiden benötigt werden, zuerst in diesen transferieren.
Hierzu entwarfen wir am Computer (in silico) ein modifiziertes BGC, basierend auf der DNA-Sequenz des nativen Cystobactamid-Produzenten Cystobacter velatus Cbv34. Dieses modifizierte BGC wurde anschließend stückweise chemisch synthetisiert und im Labor zusammengefügt, bevor wir es in M. xanthus DK1622 einbrachten. Die Cystobactamid-Produktionsraten in diesem Stamm waren letztendlich sogar deutlich höher als bisher veröffentlichte Werte aus den nativen Stämmen.
Ihr beschreibt die Aufklärung der einzelnen Schritte in der Biosynthese der Cystobactamide. Wieso ist es wichtig diese Schritte so genau zu kennen?
Das Verständnis der Biosyntheseschritte eröffnet zum Beispiel die Möglichkeit die Cystobactamid-Biosynthese gezielt zu manipulieren, um neue Derivate mit verbesserten Eigenschaften zu produzieren oder potenzielle geschwindigkeitslimitierende Biosyntheseschritte zu identifizieren und zu beseitigen.
Zudem hilft die Aufklärung der Cystobactamid-Biosynthese das generelle Verständnis von NRPS-Systemen zu verbessern. Es zeigt sich zunehmend, dass die in der Literatur beschriebene prototypische Funktionsweise und Klassifizierung von NRPS-Systemen auf der Erforschung einiger weniger Systeme, z.B. aus Actinobakterien, basiert. Myxobakterien sind jedoch nur entfernt verwandt mit Actinobakterien und die Funktionsweise myxobakterieller NRPS-Systeme scheint sich signifikant von anderen NRPS-Systemen zu unterscheiden. Das resultiert unter anderem auch in den einzigartigen Strukturen der Naturstoffe, die nur in Myxobakterien vorzufinden sind. Unsere Ergebnisse helfen dabei diese unterschiedlichen und neuartigen Funktionsweisen von myxobakteriellen NRPS-Systemen aufzuklären.
Was sind die Besonderheiten bei der Cystobactamid-Biosynthese? Gibt es Besonderheiten die es so bei anderen Naturstoffen nicht gibt?
Als die Erforschung von NRPS-Systemen noch in ihren Kinderschuhen steckte, wurde versucht allgemeingültige Regeln für deren Funktionsweise aufzustellen. So entstanden beispielsweise die Kolinearitätsregel, die besagt, dass jede funktionale Untereinheit einer NRPS (sog. Modul) für den Einbau eines Bausteins in das finale Produkt verantwortlich ist. Darüber hinaus besagt die Prozessivitätsregel, dass die Biosynthese mit dem ersten Modul startet und sequenziell bis zum terminalen Modul fortgesetzt wird. Mit der Zeit wurden jedoch immer mehr Ausnahmen für diese Regeln gefunden, so wie es nun auch in der Cystobactamid-Biosynthese der Fall ist.
Die größte Besonderheit ist hier die Biosynthese der Linkereinheit. Diese wird durch ein eigenständiges NRPS-Modul durchgeführt, das nicht Bestandteil der zwei großen Hauptproteine der NRPS ist.
Dieses Modul agiert im Zusammenspiel mit zwei weiteren, externen Enzymen und trägt so zur strukturellen Vielfalt in der Linkergruppe der Cystobactamide bei. Zudem wurde in diesem NRPS-Modul eine häufig in Naturstoff-Biosynthesen gefundene, aber zuvor nie experimentell charakterisierte bifunktionale Domäne beschrieben, die entweder die Dehydratisierung oder die Isomerisierung von l-Asparagin katalysieren kann. Welche Reaktion favorisiert wird, hängt von der Aktivität eines Oxygenase-Enzyms ab, das l-Asparagin hydroxyliert und folglich die Dehydratisierung zu β-Cyano-l-Alanin verhindert. Eine weitere Besonderheit ist der Transportprozess der Linkereinheit vom eigenständigen NRPS-Modul zur NRPS, der über ein spezielles Transportprotein durchgeführt wird. Diese Biosyntheseprozesse stehen im direkten Widerspruch mit der Prozessivitätsregel.
Des Weiteren haben wir selbst nach künstlicher Entfernung des Linker-Transportproteins die Produktion eines Cystobactamid-Tripeptids festgestellt, welches von den drei terminalen Modulen der NRPS produziert wird. Das bedeutet, dass dieses Tripeptid kein Abbauprodukt des fertigen Cystobactamid-Moleküls ist und, dass dessen Biosynthese nicht vom ersten, sondern von einem Modul inmitten der NRPS beginnen muss. Damit „verstößt“ die Cystobactamid-Biosynthese also auch gegen die Kolinearitätsregel.
Ist die Biosynthese der Cystobactamide nun vollständig aufgeklärt oder sind noch weitere Überraschungen in zukünftigen Experimenten zu erwarten?
Es gibt noch die ein oder andere offene Frage, die wir durch unsere bisherigen Experimente nicht beantworten konnten. Beispielsweise haben wir die Funktion der bifunktionalen NRPS-Domäne, die an der Cystobactamid Linkerbiosynthese beteiligt ist, nur durch deren Deletion gezeigt. Die Deletion kann wiederum zum Verlust von essenziellen Protein-Protein-Interaktionen führen und somit auch die Aktivität anderer Enzyme beeinflussen, die nur im Komplex arbeiten. In zukünftigen Experimenten wollen wir durch das gezielte Einbringen von Punktmutationen im BGC bestimmte katalytisch aktive Aminosäuren in dieser Domäne austauschen. Idealerweise würden wir somit eine der beiden Funktionen inaktivieren ohne Einfluss auf andere Enzyme zu nehmen, die die intakte Struktur der bifunktionalen Domäne benötigen.
Wie geht es jetzt weiter? Was sind die nächsten Schritte bei der Entwicklung von Cystobactamid zu einem fertigen Medikament?
Wir werden versuchen das Wissen, das wir über die Cystobactamid-Biosynthese erlangt haben, so anzuwenden, dass wir das Cystobactamid-Produktionsprofil in M. xanthus DK1622 in Richtung aktiverer Derivate lenken. Bisher gelang uns das schon teilweise, indem wir die bifunktionale NRPS-Domäne entfernt haben. Allerdings vermuten wir, dass die gesamte Linkerbiosynthese und der Transport des Linkers zur NRPS geschwindigkeitslimitierende Reaktionen darstellen. Ein geplanter Ansatz besteht darin ein inaktives NRPS-Modul, dessen Funktion durch das eigenständige NRPS-Modul übernommen wurde, zu reaktivieren. Dadurch hoffen wir die Cystobactamid-Produktion so zu verbessern, dass unser System alternativ zur etablierten chemischen Synthese von Cystobactamiden genutzt werden kann.
Bezüglich der Entwicklung von Cystobactamid zu einem fertigen Medikament wurden mittels Medizinalchemie bereits einige neue Derivate hergestellt, die aktiver sind als natürliche Cystobactamide. Diese vielversprechenden Derivate werden momentan auf ihre klinische Verwendbarkeit getestet.
Das Interview führte Dr. Yannic Nonnenmacher
Originalpublikation:
Sebastian Groß, Bastien Schnell, Patrick A. Haack, David Auerbach, and Rolf Müller: In vivo and in vitro reconstitution of unique key steps in cystobactamid antibiotic biosynthesis. Nature Communications, 2021. doi: 10.1038/s41467-021-21848-3











![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/c/9/csm_HZI_wiss_hemmhof_mik_001_611abc3df4.jpg)


![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/1/b/csm_Andreas_Keller_2023_org_4a279f0c07.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/b/3/csm_AufDiePlaetze_WID-8615_4ee837e55b.jpg)
![[Translate to German:] Künstliche Intelligenz unterstützt die Entdeckung von Arzneimitteln aus Naturstoffen](/fileadmin/HIPS/__processed__/3/e/csm_AI_in_NP_Drug_Discovery_AdobeStock_cb35048970.jpg)














![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/f/b/csm_Hegemann_Julian_a8a2ed3682.jpg)


![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/2/b/csm_HZI_wiss_pseudomonas_cpi_hzi_001_62730ae12d.jpg)