Saarbrücken, 20. November 2023 - Wie bereits im letzten Jahr steht die World AMR Awareness Week 2023 unter dem Motto „Antimikrobielle Resistenz gemeinsam verhindern“. Im Kampf gegen resistente Erreger und deren Verbreitung spielt erfolgreiche Zusammenarbeit an mehreren Stellen eine entscheidende Rolle, unter anderem bei der Entwicklung neuer Wirkstoffe. Hier ist insbesondere die Schnittstelle zwischen akademischer Forschung und klinischer Anwendung ein kritischer Punkt, an dem zahlreiche Projekte scheitern. Um genau diese Lücke zu adressieren, wurde der Baseler Inkubator INCATE gegründet, der gezielt Projekte mit vielversprechenden Ansätzen zu Bekämpfung antimikrobieller Resistenzen fördert. Am Helmholtz-Institut für Pharmazeutusche Forschung Saarland (HIPS) werden aktuell zwei Projekte von INCATE gefördert: eines zu Pathoblockern gegen Pseudomonas aeruginosa in der Abteilung von Anna Hirsch und eines zum Naturstoff Chlorotonil unter der Leitung von Rolf Müller. Im Interview erzählen die HIPS Wissenschaftlerinnen und Wissenschaftler Jörg Haupenthal, Jennifer Herrmann und Andreas Kany, worum es in den beiden Projekten geht.
Neue Pathoblocker gegen Pseudomonas aeruginosa (Abteilung WIRKSTOFFDESIGN UND OPTIMIERUNG)
Jörg, euer Projekt trägt den Namen Paerublock – wie kommt der Name zustande und wofür steht er?
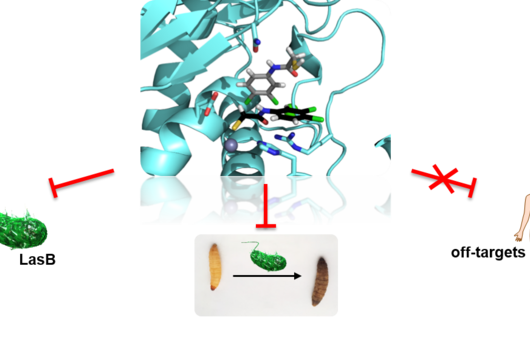
Jörg Haupenthal: Hierbei handelt es sich um ein Kunstwort, das sich vom adressierten Keim „Pseudomonas aeruginosa“, sowie dem Wort „Pathoblocker“ ableitet. P. aeruginosa ist demzufolge der Erreger, den wir in unserem Projekt bekämpfen, und Pathoblocker nennt man unsere Wirkstoffe. Dabei handelt es sich um eine neu entwickelte Alternative zu herkömmlichen Antibiotika.
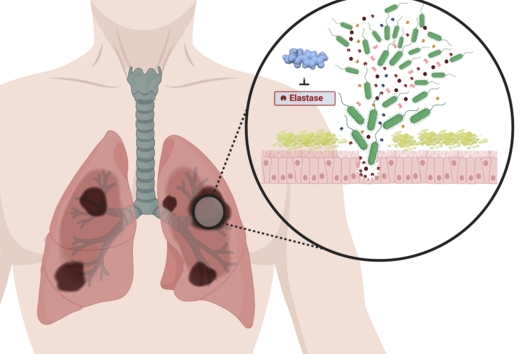
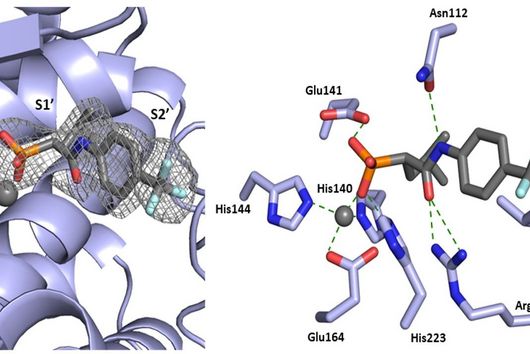
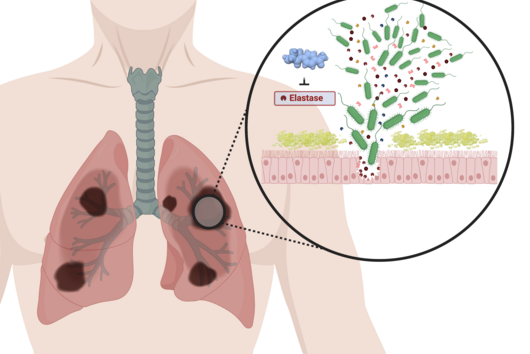
Die von euch entwickelten Wirkstoffe sollen nicht direkt am krankmachenden Bakterium selbst wirken, sondern zielen auf ein Protein, das von diesen Bakterien bei einer Infektion produziert und in den menschlichen Körper abgegeben wird. Wie funktioniert dieser Ansatz?
Jörg Haupenthal: Während klassische Antibiotika Ziele im oder am Bakterium angreifen, interessieren wir uns für ein Enzym, das vom Krankheitserreger produziert und ausgeschieden wird – die sogenannte Elastase. Dieses Enzym ist dazu in der Lage, einen Bestandteil des menschlichen Gewebes abzubauen und hilft dem Bakterium damit bei der Gewebepenetration, der Umgehung der Immunantwort, sowie der Nährstoffgewinnung. Durch eine pharmazeutische Hemmung des Enzyms tötet man das Bakterium zwar nicht ab, setzt aber seine krankmachenden Eigenschaften drastisch herab. Dies wiederum erleichtert es dem Immunsystem und klassischen Antibiotika erheblich, mit dem Keim fertig zu werden. Daher auch der Name Pathoblocker – es geht darum, die Pathogenität des Keims abzumildern bzw. zu blockieren.
Wie weit ist Paerublock aktuell bereits fortgeschritten und wie unterstützt euch die INCATE-Förderung bei der weiteren Entwicklung?
Jörg Haupenthal: P. aeruginosa verursacht verschiedene Infektionskrankheiten und somit spielt auch die Elastase in unterschiedlichen infizierten Organen eine Rolle, so in der Lunge und im Auge. Unsere hier wirkenden Hemmstoffe sind sehr potent, zeigen bisher keine Toxizität und erreichen ihren Wirkort in ausreichenden Mengen. Nun gilt es, gemeinsam mit von INCATE ausgewählten Expert:innen, den experimentellen Tests den letzten Feinschliff zu geben. Dies soll nicht nur die in vivo Effektivität bestätigen, sondern auch therapeutische Bedingungen schaffen, die denen im Menschen möglichst nahe kommen. Erste klinische Studien werden im Erfolgsfall vorbereitet.
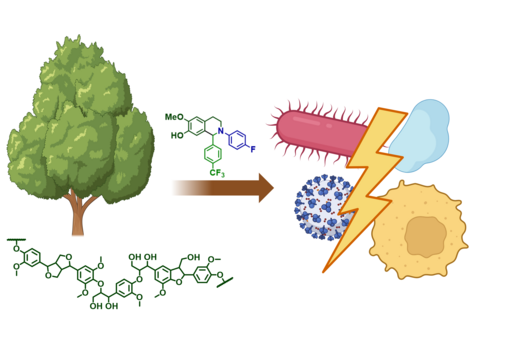
Optimierung des Naturstoffes Chlorotonil (Abteilung MIKROBIELLE NATURSTOFFE)
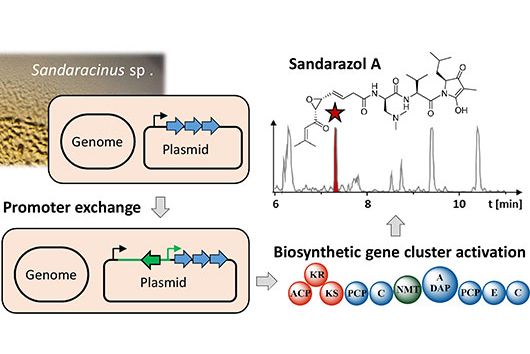
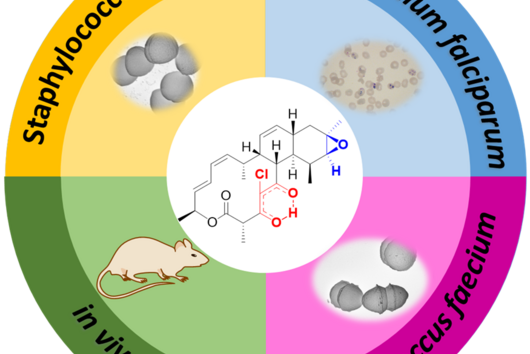
Jennifer und Andreas, mit der eingeworbenen Förderung durch den Inkubator INCATE wollt ihr die Naturstoffklasse der Chlorotonile zu einem Wirkstoff gegen Krankenhauskeime entwickeln. Im September hat das HIPS zusätzlich Fördermittel aus der BMBF-Initiative „GO-Bio initial“ eingeworben – in diesem Projekt sollen Chlorotonile allerdings zur Behandlung von Malaria eingesetzt werden. Wie passt das zusammen?
Jennifer Herrmann: Chlorotonile zeigen eine äußerst potente Wirksamkeit sowohl gegen wichtige Krankenhauskeime wie Vancomycin-resistente Enterokokken (VRE) und Methicillin-resistente Staphylococcus aureus (MRSA) als auch gegen den Malariaerreger Plasmodium falciparum. Aus diesem Grund bearbeiten wir das Projekt zweigleisig: Zum einen arbeiten wir an der Optimierung in Richtung eines Antibiotikums zur Behandlung schwerer bakterieller Infektionen, unterstützt durch INCATE, zum anderen streben wir die Entwicklung eines Malariamedikaments an, was wiederum durch GO-Bio initial unterstützt wird. Da es sich hierbei um grundsätzlich unterschiedliche Indikationen handelt, sind jeweils unterschiedliche Aspekte zu adressieren, beispielsweise im Hinblick auf die Infektionsmodelle im Tier. Auch die Anforderungen an das Medikament selbst und seine Verabreichungsform sind sehr unterschiedlich. So soll beispielsweise die Behandlung von Malaria primär durch Tabletten geschehen, wohingegen die Therapie von schweren bakteriellen Infektionen im Krankenhaus meist über eine intravenöse Gabe erfolgt. Es ergeben sich aber auch Synergien zwischen den beiden Entwicklungszweigen, etwa bei der biotechnologischen Produktion der Wirkstoffe, die wir in beiden Fällen nutzen können.
Neben einer sehr guten antimikrobiellen Aktivität verfügen die Chlorotonile auch über einen neuartigen Wirkmechanismus. Könnt ihr erklären, warum das für neue Antibiotika so wichtig ist?
Andreas Kany: Die meisten neuen Antibiotika, die gerade in klinischen Phasen getestet werden, besitzen ähnliche Wirkmechanismen wie Antibiotika, die bereits auf dem Markt sind. Dies erhöht das Risiko, dass bereits existierende Resistenzmechanismen schnell auf die neuen Antibiotika adaptiert werden können. Unser übergeordnetes Ziel ist es aber, der zunehmenden Verbreitung von Antibiotikaresistenzen entgegenzuwirken, indem wir Antibiotika mit neuartigen Wirkmechanismen entwickeln. In diesem Zusammenhang konnten wir unter Laborbedingungen bisher nur einen äußerst geringen Trend zur Resistenzbildung für die Chlorotonile beobachten, was die Substanzklasse besonders vielversprechend macht.
Wie weit ist die Entwicklung dieser Substanzklasse bisher fortgeschritten und welche Hürden müssen vor einer potentiellen Vermarktung noch genommen werden?
Andreas Kany: Wir befinden uns aktuell an der Schwelle zur sogenannten Leitstruktur-Optimierung. Das heißt, wir konnten ein sehr vielversprechendes Molekül aus der Klasse der Chlorotonile identifizieren, für das wir die sehr gute Wirksamkeit und Verträglichkeit im Tiermodell bereits bestätigen konnten. Weitere Optimierungen umfassen beispielsweise die Synthese weiterer noch besserer Derivate und ein tiefes Verständnis ihrer pharmakologischen und sicherheitsrelevanten Eigenschaften. Wenn diese Hürden genommen sind, soll ein Kandidatenwirkstoff ausgewählt werden, für den wir dann die klinische Entwicklung anstreben.

![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/c/9/csm_HZI_wiss_hemmhof_mik_001_a5414f08d0.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/c/9/csm_HZI_wiss_hemmhof_mik_001_611abc3df4.jpg)












![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/1/b/csm_Andreas_Keller_2023_org_4a279f0c07.jpg)
![[Translate to German:] [Translate to German:]](/fileadmin/HIPS/__processed__/b/3/csm_AufDiePlaetze_WID-8615_4ee837e55b.jpg)
![[Translate to German:] Künstliche Intelligenz unterstützt die Entdeckung von Arzneimitteln aus Naturstoffen](/fileadmin/HIPS/__processed__/3/e/csm_AI_in_NP_Drug_Discovery_AdobeStock_cb35048970.jpg)














![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/f/b/csm_Hegemann_Julian_a8a2ed3682.jpg)


![[Translate to Deutsch:] [Translate to Deutsch:]](/fileadmin/HIPS/__processed__/2/b/csm_HZI_wiss_pseudomonas_cpi_hzi_001_62730ae12d.jpg)